SUPERANTIGENI – INDUKATORI NEKONVENCIONALNE IMUNE REAKCIJE
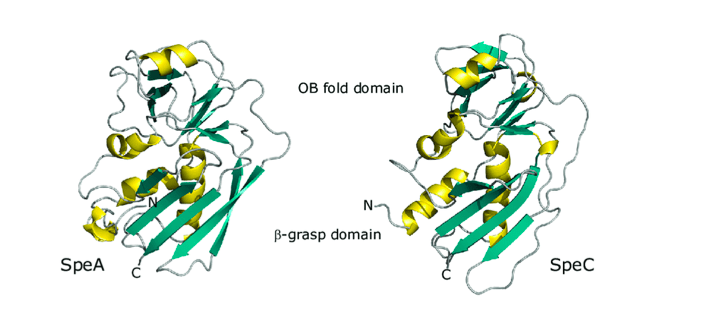
1. OB nabor (oligosaccharide/oligonucleotide binding fold) koji sadrži pet isprepletenih β-barrel proteina u obliku Grčkog ključa. Ovaj dio se naziva i N – terminalnim dijelom.
2. β – hvataljka (β – grasp) koja je u obliku beta nabrane ploče, a praćena je izduženim α heliksom. Ovaj dio se naziva i C – terminalnim dijelom. (7, 8)
3.1. Interakcija superantigena sa MHC II
Antigeni tkivne podudarnosti su određeni genima koji se nazivaju glavnim kompleksom gena tkivne podudarnosti (major histocompactibility complex). Riječ kompleks je uvedena kada je otkriveno da na odgovarajućem mjestu 6. hromosoma ne postoji jedan lokus nego niz gena. Ti geni su nazavani skraćenicom MHC (major histocompatibility complex), a njihovi produkti, molekule MHC, nalaze se u različitim količinama u ćelijama čovjekovog organizma. Ovaj sistem se naziva i HLA (eng. human leukocyte antigens) jer je prvo otkriven na leukocitima.
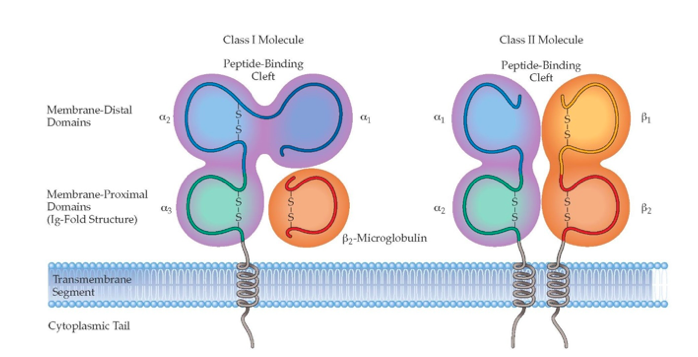
Geni i molekule su podijeljene iz funkcionalnih razloga u tri skupine: MHCI, MHCII i MHCIII. Prva dva imaju veoma bitnu ulogu u prepoznavanju i predočavanju antigena. Prilikom prepoznavanja antigena od strane APC (antigen prezentujuća ćelija), a preko MHCII molekule dolazi do specifične reakcije. Kod superantigena nema specifičnog prepoznavanja, zbog čega nastupa sistemska imuna reakcija. (9, 10)
Histokompaltibilni kompleks klase II se sastoji od dva, međusobno slična, nekovalentno vezana lanca. To su α i β lanac. Ova dva lanca su podjeljena u podjedinice koje se sastoje od po 90 aminokiselina, a to su α1, α2 i β1,β2 podjedinice.
Superantigeni se spajaju na MHCII molekulu, na njen β lanac. Spajanje se vrši posredstvom cinka (Zn), koji omogućava čvrstu vezu između ove dvije partikule. Specifično mjesto vezivanja superantigena i MHCII jeste područje koje se označava kao HLA – DR receptor na β lancu. Nekoliko stafilokoknih superantigena imaju sposobnost vezivanja za MHCII molekule pomoću cross-linking-a, prilikom čega dolazi do spajanja α i β lanca posredstvom ovog superantigena. (4, 5)
3.2. Interakcija superantigena sa receptorom T limfocita
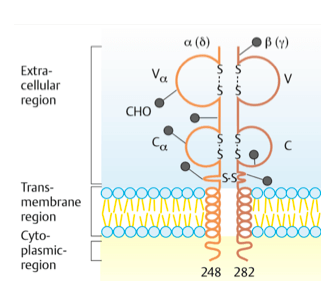
Antigenski receptor limfocita T (TCR, eng. T-cell receptor) je građen od dva polipeptidna lanca. S obzirom na vrstu lanca, razlikuju se dvije vrste receptora: TCR – αβ i TCR – γδ. Oko 95% limfocita u perifernoj krvi su građeni sa TCR – αβ receptorima. Za razliku od B limfocita, T limfocit ostaje nepromjenjen na ćeliji tokom svih faza imunog odgovora. (9)
TCR receptor se sastoji od varijabilne regije (V), i stalne regije (C). U varijabilnim regijama se nalaze hipervarijabilne regije koje su različite u svakom klonu limfocita, pa se zbog toga nazivaju i klonotipskim receptorima. (9, 10)
Na osnovu mjesta vezivanja superantigena za TCR, superantigeni su podijeljeni u grupe. (4) Grupe superantigena su:
· I grupa SAgs
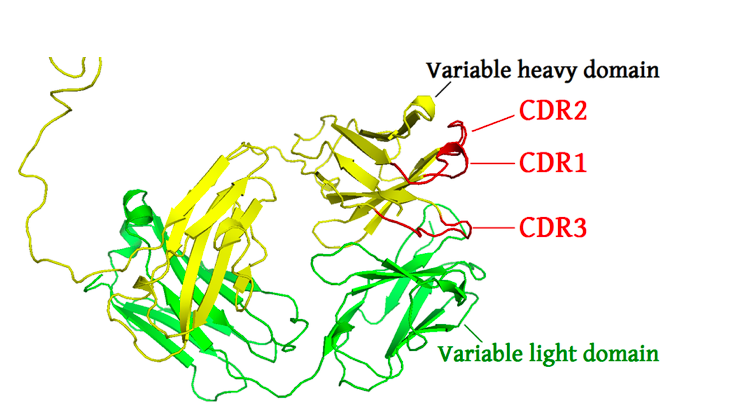
Superantigen se na TCR-u veže za varijabilni β dio. Specifični dijelovi sa kojim se spaja superantigen se naziva komplementarno – determinantnom regijom (CDRs, eng. complementarity-determining regions). Razlikujemo CDR1, CDR2, CDR3, a za svaki ponaosob se može vezati određeni superantigen.
· II grupa SAgs
Superantigeni se u ovom slučaju vežu konformacijski, pri čemu dolazi do promjene rasporeda atoma u superantigenu. Promjenom rasporeda atoma u proteinu, u ovom slučaju, ne dolazi do cijepanja kovalentnih veza.
· III grupa SAgs
Superantigeni ove grupe se vežu na sve tri komplementarno – determinantne regije (CDR), koji se nalaze na β varijabilnom lancu. (4, 6)
4. MEHANIZAM DJELOVANJA SUPERANTIGENA
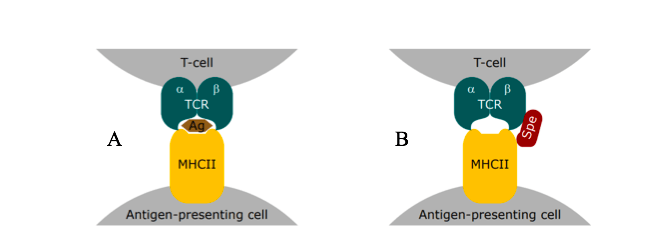
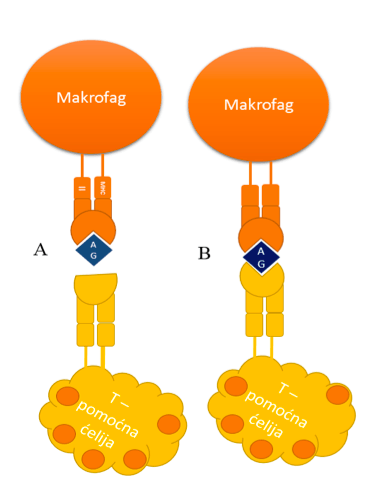
Imuna reakcija počinje prepoznavanjem kompleksa MHC i antigena. Ovaj kompleks prepozna odgovarajući T limfocit pomoću svog receptora (TCR, T-cell receptor). Imuna reakcija će nastati samo u slučaju kada se podudare navedene strukture, dok ona nije moguća u konvencionalnoj imunoj reakciji, ako ne postoji potpuna podudarnost ovih molekula. (4, 9, 10)
MHCII i antigen kompleks su dio strukture koja se naziva trimolekularni kompleks, a pored ove dvije partikule sačinjava ga i receptor T limfocita (TCR). (9)
Dio receptora TCR-a koji veže kompleks MHCII – antigen čine hipervarijabilne regije α i β lanca. Ove regije se označavaju sa CDR (CDR1,CDR2,CDR3). Ima ih ukupno 6, po tri na svakom lancu. Pomoću ovih polimorfnih CDR struktura, receptor T ćelije se utiskuje između najizbočenijih dijelova na α i β lancu i prepoznaje vezani antigen. Afinintet vezanja TCR i MHC – antigen kompleksa, je znatno niži od imunoglobulinskog receptora, a produkt toga jeste nastanak imunološke sinapse preko koje se prenose signali da bi se aktivirao T limfocit.
Aktivirana T pomoćna ćelija (eng. T helper cell) luči citokine, te se veže sa B limfocitnom ćelijom. Rezultat toga je stimulacija kloniranja B limfocita, a poslijedica povećanje broja antitijela, koji aktivno učestvuju u odbrani čovjekovog organizma od patogenih uzročnika.
Superantigeni imaju sposobnost da u potpunosti izbjegnu ovakav princip i slijed imune reakcije.
Superantigeni se vežu za MHCII i receptor T pomoćnog limfocita bez posredstva antigena, koji je ključan za specifičnu i lokalnu imunu reakciju. Poslijedica toga jeste sistematska imuna reakcija, koja ima dosta veće poslijedice na čovjekov organizam i može izazvati smrt.
Naime, superantigen poveže MHCII i TCR na nekonvencionalan način, što za poslijedicu ima nekontrolisano lučenje citokina u krv.
Vezivanje superantigena, bez prisustva antigena, se vrši na MHCII na njegovo specifično mjesto vezivanja receptor HLA – DR koji se nalazi na β lancu histokompaktibilne molekule druge klase. Vezivanje na T limfocitnom receptoru se vrši na komplementarno – determinantnim regijama, koje su smještene na hipervarijabilnim dijelovima ovog receptora.
5.DJELOVANJE SUPERANTIGENA NA ČOVJEKOV ORGANIZAM
Ulazak patogena i njegovo prepoznavanje od strane čovjekovog imunog sistema izaziva imunu reakciju. Stepen intenziteta imune reakcije zavisi od broja patogenih mikroorganizama koji se dospiju do čovjekovog organizma. Kao što je već predstavljeno imuni odgovor kod oslobađanja superantigena nije standardni imuni odgovor i teško ga je kontrolisati, pogotovo kada se radi o hiperprodukciji superantigena od mikroorganizama. Količina od 0,1 μg/ml superantigena u krvi može izazvati masivnu aktivaciju T limfocita, koji sekretuju citokine.
Aktivirani T limfociti stvaraju masivnu imunu reakciju, koja je nespecifična za bilo koji epitop na antigenu. Epitop predstavlja specifično mjesto na antigenu, koje se spoji sa antitijelom. Na ovome se zasniva specifični imunitet. Superantigen zaobilazi ovaj konvencionalni način imune reakcije i aktivira veliki broj T limfocita. Poslijedica toga jeste masovno oslobađanje citokina, naročito interferona gamma (IFNγ), koji aktivira makrofage. Aktivirani makrofag oslobađa proinflamatorne citokine, kao što su interleukin 1 i 6 (IL – 1; IL – 2), te faktor nekroze tumora alfa (TNFα/cahexin). (4)
Kaheksin ili TNFα, kada je u normalnim razmjerima, pri antigenskim indukovanim imunim reakcijama, se oslobađa lokalno i djeluje antiinflamatorno. Kod indukcije imune reakcije superantigenom dolazi do sistematskog oslobađanja kaheksina i porasta njegovog nivoa u krvi, što za poslijedicu ima porast propustljivosti kapilara. To odovodi do gubitka plazme, te porasta tjelesne temperature, pojave goznice, šok, i na poslijetku otkazivanje organa. (1, 2, 4)
Superantigeni koje produkuje Staphylococcus aureus imaju sposobnost da izazovu mnoga patološka stanja, uključujući i sindrom toksičnog šoka (TSS). Danas je poznato da ova bakterija stvara preko 20 različitih superantigena. U više od 60% slučajeva infekcija bakterijom Staphylococcus aureus, izoliran je barem jedan superantigen kojeg produkuje. (11)
Superantigeni koji se najčešće izoluju su: stafilokokni enterotoksin sličan proteinu (enterotoksin-like protein, SE-ls) i TSS toksin 1 (TSST-1). (12)
Poslijedice koje izaziva TSST-1, nazivaju se sindromom toksičnog šoka. Početak kod ove bolesti je nagao, s povišenom temperaturom (39° do 40,5° C, koja ostaje visoka), hipotenzijom i difuznim makularnim eritemom te zahvaćanjem barem 2 organska sistema. Stafilokokni TSS često izaziva povraćanje i proljev, mijalgiju i povišenje CPK (kreatin fosfokinaza), upalu sluznica, oštećenje jetre, trombocitopeniju i konfuziju. Veća je vjerojatnost da će se osip između 3. i 7. dana nakon početka bolesti kod stafilokoknog TSS–a ljuštiti, osobito na dlanovima i tabanima. Streptokokni TSS često uzrokuje sindrom respiratornog distresa, koagulopatiju i oštećenje jetre, te češće izaziva vrućicu, malaksalost i jaku bol na mjestu infekcije mekog tkiva. Sindrom u roku od 48 h može napredovati do sinkope, šoka i smrti. Lakši slučajevi stafilokoknog TSS–a su prilično česti. (13)
Pored TSS-a, u bolesti koje su uzrokovane djelovanjem superantigena ubrajamo diabetes mellitus, psorijaza, Kawasakijeva bolest, nazalni polipi, reumatska groznica, reumatoidni artritis, infektivni endokarditis, Chron-ova bolest itd. (14, 15)
6. NEUTRALIZACIJA DJELOVANJA SUPERANTIGENA I LIJEČENJE
Obzirom da superantigeni spadaju u skupinu egzotoksina, i da se luče iz živih bakterija, potrebno je neutralizirati njihovo toksično djelovanje. Najdjelotvornija antitijela u neutralizaciji su IgG i IgA. Antitijela IgG su naročito važna jer imaju sposobnost difundovanja u vanstanični (tkivni) prostor. Mogu se vezati za aktivno mjesto toksina i na taj način spriječiti njihovo djelovanje. Vezanje na druga mjesta na toksinu može dovesti do konformacije molekule toksina ili stvoreni imunokompleks bude podložniji uklanjanju procesom fagocitoze. (1)
Jedna od najčešćih bolesti koje nastaju dejstvom superantigena jeste opisani TSS (sindrom toksičnog šoka). Terapija koja se daje kod TSS-a zavisi od uzročnika, obzirom da ga može uzrokovati široki spektar bakterija pored s. aureus. Najučinkovitijim se pokazalo liječenje β–laktamom (npr. penicilinom) uz klindamicin (900 mg IV svakih 8 h) 14 dana. Pasivna imunizacija na toksine TSS–a pomoću IV imunog globulina (400 mg/kg) se pokazala korisnom u teškim slučajevima TSS–a, a traje tjednima, a sama bolest ne mora izazvati aktivnu imunost pa su mogući recidivi. (13)
Superantigeni su posebna grupa egzotoksina, kojeg produkuju bakterije i virusi. Ove partikule imaju sposobnost da aktiviraju T limfocite, tako što se istovremeno vežu na receptore T limfocita, i na molekule glavnog histokompatibilnog kompleksa II klase. Vezivanje ovih struktura se vrši bez antigena. Poslijedica toga jeste lučenje citokina koji mogu izazvati, po život, opasne reakcije. Dijagnosticiranje je otežano jer manifestacija je slična mnogim autoimunim oboljenjima.
Pored opštih dejstava infekcije, superantigeni mogu izazvati dodatne komplikacije zbog aktiviranja nespecifične imune reakcije, koja može rezultirati sistematskim djelovanjem. Brzo djelovanje i terapijski tretman su veoma bitni, jer se kao poslijedica može javiti otkazivanje organa, intoksikacija organizma, šok, te na poslijetku letalan ishod. Jedini način da se izbjegne letalan ishod jeste rano kauzalno liječenje.
Superantigeni se intenzivnije izučavaju u poslijednje vrijeme, jer se dovode u vezu sa mnogim oboljenjima koja su smatrana idiopatskim, a do sada su opisani mnogi superantigeni bakterijskog porijekla.
1) Uzunović-Kamberović S. Patogeneza bakterijskih infekcija. Iz: Uzunović – Kamberović S. Medicinska mikrobiologija. Štamparija Fojnica, Zenica. 2009: 113 - 118.
2) Us D. „Viral superantigens“. Mikrobiyol Bul. 2016;50(3):491-504.
3) Llewelyn M, Cohen J. Superantigens: microbial agents that corrupt immunity. Lancet Infect Dis. 2002; 2 (3): 156– 162.
4) Petersson K, Forsberg G, Walse B. Interplay between superantigens and immunoreceptors. Scand. J. Immunol. 2004; 59 (4): 345–355.
5) Mehindate K, Thibodeau J, Dohlsten M, Kalland T, Sékaly RP, Mourad W. Cross-linking of major histocompatibility complex class II molecules by staphylococcal enterotoxin A superantigen is a requirement for inflammatory cytokine gene expression". J. Exp. Med. 1995; 182 (5): 1573– 1577.
6) Brouillard JN, Günther S, Varma AK, et al. Crystal structure of the streptococcal superantigen SpeI and functional role of a novel loop domain in T cell activation by group V superantigens. J. Mol. Biol. 2007; 367 (4): 925– 934.
7) Schlievert PM. Enhancement of host susceptibility to lethal endotoxin shock by staphylococcal pyrogenic exotoxin type C. Infect. Immun. 1982; 36 (1): 123– 128.
8) Babbar A. Streptoccocal Superantigens. Helmholtz Center for Infection Research, Braunschweig, Germany. 2015.: 19 – 20.
9) Andreis I, Batinić D, Čulo F, Grčević D, Lukinović – Škudar V, Marušić M, Taradi M, Višnjić D. Imunologija, sedmo, obnovljeno i dopunjeno izdanje. Medicinska naklada, Zagreb. 2010: 100 – 105.
10) Abbas KA, Lichtman AH, Pillai S. Stanična i molekularna imunologija. Medicinska naklada, Zagreb. Bez godine izdanja: 108 – 113.
11) Becker K, Friedrich AW, Lubritz G, Weilert M, Peters G, Von Eiff C. Prevalence of genes encoding pyrogenic toxin superantigens and exfoliative toxins among strains of Staphylococcus aureus isolated from blood and nasal specimens. J. Clin. Microbiol. 2003; 41(4), 1434–1439.
12) Schlievert PM, Case LC, Strandberg KL, Tripp TJ, Lin YC, Peterson ML. Vaginal Staphylococcus aureus superantigen profile shift from 1980 and 1981 to 2003, 2004, and 2005. J. Clin. Microbiol. 2007; 45(8), 2704–2707.
13) http://www.msd-prirucnici.placebo.hr/msd-prirucnik/infektologija/gram-pozitivni-koki/sindrom-toksicnog-soka (Pristup stranici: 06.03.2019. u 22:34)
14) Van Cauwenberge P, Gevaert P, Van Hoecke H, Van Zele T, Bachert C. New insights into the pathology of nasal polyposis: the role of superantigens and IgE. Verh K Acad Geneeskd Belg. 2005; 67 (5–28): 5–28, discussion 29–32.
15) Salgado-Pabón W, et al. Superantigens are critical for Staphylococcus aureus infective endocarditis, sepsis, and acute kidney injury. MBio. 2013; 4:e00494-00413.