Primena CRISPR-Cas9 u medicini
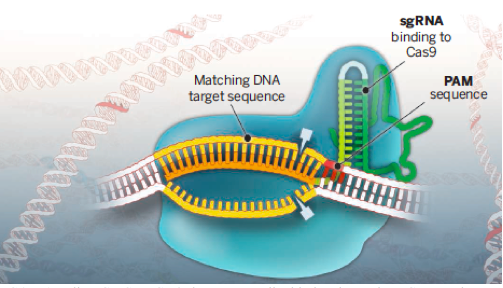
CRISPR-Cas čine Cas protein, koji zahvaljući svojoj aktivnosti seče stranu DNK. Za njega se vezuje CRISPR RNK koju čine RNK vodič (usmerava kompleks do ciljne sekvence strane DNK) i transkipt koji stabilizuje Cas protein. Takođe, bitnu ulogu u celom procesu igra i PAM motiv, koji se vezuje susedno od ciljne sekvence i potpomaže u vezivanju CRISPR-Cas kompleksa. Ovaj adaptivni imuni odgovor se odigrava u tri koraka: 1. ubacivanje viralne DNK kao spacer sekvence u okviru CRISPR-a, 2. transkripcija, pri čemu nastaje pre-CRISPR RNK koja se kasnije modifikuje kako bi nastale zrele i pojedinačne CRISPR RNK i 3. odstranjivanje strane DNK uz pomoć kompleksa CRISPR-RNK i Cas proteina (Doudna i Charpentier 2014).
Strukturno gledano, Cas9 je protein koji poseduje dva nukleazna i helikazni domen pomoću kojih ostvaruje svoj zadatak. Nakon vezivanja RNK za Cas protein dolazi do konformacionih promena koje se dalje odvijaju i tokom interakcije sa ciljnom DNK sekvencom (Doudna i Charpentier 2014). Kod bakterije Streptococcus pyogenes je utvrđeno da CRISPR-Cas sistem predstavlja RNK posredovanu DNK endonukleazu, što znači da RNK usmerava protein da iseče DNK (Jinek i sar. 2012). Helikazni domen služi da odstani DNK lanac koji je komplementaran RNK vodiču (Jinek i sar. 2012). CRISPR RNK je dizajnirana kao jednolančana RNK koju karakterišu dve osnovne karateristike: prisustvo sekvence od 20 nukleotida koja omogućuje komplementarno vezivanje za ciljnu DNK sekvencu, kao i 3’ kraj RNK koji se vezuje za Cas protein (Jinek i sar. 2012).
Nakon uspešnih preliminarnih istraživanja u izmeni genoma humanih ćelija, CRISPR-Cas9 tehnika postaje neizostavni deo istraživanja koja se bave genetičkim inženjeringom sa ciljem boljeg razumevanja određenih bolesti, kao i njihovom potencijalnom iskorenjivanju. U narednim pasusima sledi analiza primene CRISPR-Cas9 sistema u lečenju pojedinih bolesti.
Tokom istraživanja nove terapije protiv melanoma, primenjivan je CRISPR-Cas9 sistem tako što su Cas9 proteini bili sintetisani u obolelim ćelijama (Manguso i sar. 2017). Nakon toga je usledio dizajn RNK za svaki od gena koji dovode do melanoma. Svi RNK molekuli su preko viralnog vektora bili ubačeni u ćelije. Upotrebom CRISPR-Cas9 sistema, izbrisan je gen Ptpn2, što je dovelo do pojačanog imunog odgovora (Manguso i sar. 2017).
CRISPR-Cas9 sistem je primenjivan i u istraživanjima sa kliničkim modelima, što je doprinelo boljem razumevanju tretmana bolesti koje su povezane sa angiogenezom. Na kliničkom modelu retine, zahvaljujući ovom sistemu, angiogeneza je sprečena i samim tim je onemogućeno čulo vida (Huang i sar. 2017). Pomoću CRISPR-Cas9 sistema je proučen i Zinsser-Engman-Cole sindrom (dyskeratosis congenita), koji dovodi do smanjenog broja krvnih ćelija. Fok i saradnici su u matičnim ćelijama uspeli da pomoću CRISPR-Cas9 sistema dovedu do mutacija koje su povezane sa ovim sindromom (Fok i sar. 2017). Kasniji rezultati ovog istraživanja su pokazali kako skraćivanja telomera može dovesti do pogoršanja hematopoetskog procesa (Fok i sar. 2017).
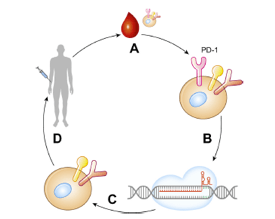
U lečenju raka, CRISPR-Cas9 sistem je već uspostavio svoju ulogu i ima veliku mogućnost da se primenjuje u različitim oblicima terapije. Prema navodima sajta clinicaltrials.gov iz 2018, CRISPR-Cas9 se primenjuje kod 10 različitih kancera, a ciljna meta ove metode su T limfociti (Zhan 2018). U kliničke svrhe protiv raka je prvi put upotrebljen u Kini 2016. godine, tako što je iz genoma T ćelija uklonjen gen za protein PD-1 (Cyranoski 2016). Nakon obrade pomoću CRISPR-Cas9 sistema, izmenjeni limfociti su ubrizgani u pacijente (Slika 2).
CRISPR-Cas9 sistem nalazi primenu i u lečenju side (AIDS). Iako postoje efikasne terapije protiv HIV virusa koje onemogućuju replikaciju virusa, one, međutim ne mogu da uklone takozvane latentne viralne rezervoare (Xiao i sar. 2019). Prvi put je ovaj metod protiv AIDS-a upotrebljen 2013. godine kada su Ebina i saradnici uspeli da suzbiju ekspresiju HIV-1 gena u Jurkat ćelijskoj liniji, i time su sprečili transkripciju i kasniju translaciju (Ebina i sar. 2013). Takođe, ista grupa istraživača je uspela da ukloni i viralne gene iz genoma ispitivanih ćelija (Ebina i sar. 2013). S obzirom da HIV virus ulazi u ćelije zahvaljujući interakcijama sa CD4 receptorima i CCR5 ili CXCR4 koreceptorima, naučnici su se okrenuli alternativnoj upotrebi CRISPR-Cas9 sistema. U istraživanju sa ćelijskom linijom HEK-293T uspešno je izvršeno utišavanje gena za koreceptor CCR5 (Cho i sar. 2013). Poznato je da su osobe koje poseduju deleciju u genu za CCR5 koreceptor imunije na infekciju HIV virusa (Xiao i sar. 2019). Pozivajući se na ovu činjenicu, u pluripotentnim matičnim ćelijama je izvršena ključna delecija CCR5∆32 pomoću ove metode. Daljom diferencijacijom su se razvili monociti i makrofazi koji pokazju rezistenciju prema HIV virusu (Ye i sar. 2014). Još jedna strategija koja se primenjuje u terapiji pomoću CRISPR-Cas9 sistema jeste “shock and kill” koji podrazumeva reaktivaciju dormantnog virusa i aktivaciju imunog odgovora (Xiao i sar. 2019). Osnovni princip ove strategije jeste da sistem Cas proteina i transkripcionih aktivatora podstaknu ekspresiju viralnih gena.
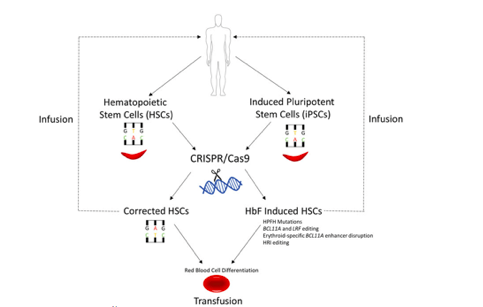
Jedna od najčešćih bolesti gde bi CRISPR-Cas9 sistem mogao da bude od velike koristi jeste srpasta anemija, koja predstavlja nasledni poremećaj koji nastaje usled mutacije na kodonu za glutamat, gde se umesto spomenutog glutamata javlja valin. Time se narušava struktura hemoglobina, čime se menja njegova struktura, kao i izgled eritrocita (Demirci i sar. 2019). Potencijalna primena (Slika 3) se ogleda u izmeni mutacije koja dovodi do srpaste mutacije ili izmenom genoma čime se indukuje ekspresija fetalnog hemoglobina (Demirci i sar. 2019). Najjednostavniji i najčešći princip jeste isecanje sekvence sa mutacijom i ubacivanje odgovarajućeg dela koji ne remeti strukturu β – globina, a prilikom indukcije fetalnog hemoglobina koriste se ex vivo ćelijske kulture i model organzimi (Demirci i sar. 2019).
Izazovi koji predstoje pred ovom metodom su efikasnost (preciznost kojom se seče odgovarajuća sekvenca), mehanizam dostavljanja CRISPR-Cas komponenti (preko nanočestica ili preko virusnih vektora), kao i dizajn i sinteza željenih RNK molekula. Osim problema tehničke prirode, javlja se i etički izazov koji se odnosi na izmenu genoma kako bi nastali savršeniji ljudi. Poznati kontroverzni primer u naučnom svetu se desio 2015. godine u Kini, kad je naučnika He Jiankui izmenio genom kako bi nastali embrioni otporni na infekciju HIV virusom. Četiri godine kasnije, doneta je presuda kojom se Jiankui osuđen na 3 godine zatvora i kažnjen je sa 430 000 dolara (New York Times, 2019).
Ako se upotreba CRISPR-Cas9 sistema u medicini ograniči na lečenje bolesti, onda možemo da očekujemo ogromnu ekspanziju ove metode. I za kraj, preporuka ukoliko imate Netflix: pogledajte dokumentarni film Human Nature koji se bavi ovom metodom i u kojoj se pojavljuju dobitnice Nobelove nagrade: Emanuel Šarpentije i Dženifer Dudna (Slika 4).
Literatura
Barrangou R, Fremaux C, Deveau H, et al. 2007, CRISPR provides acquired resistance against viruses in prokaryotes, Science, 315: 1709-1712
Cho SW, Kim S, Kim JM, Kim JS, 2013, Targeted genome engineering in human cells with the Cas9 RNA-guided endonuclease, Nat Biotechnol, 31: 230-232
Cyranoski D, 2016, CRISPR gene-editing tested in a person for the first time, Nature, 539
Demirci S, Leonard A, Haro-Mora JJ, et al. 2019, CRISPR-Cas9 for sickle cell disease: applications, future possibilities and challenges, Adv Exp Med Biol, 1144: 37-52
Doudna JA, Charpentier E, 2014, The new frontier of genome engineering with CRISPR-Cas9, Science, 346: 1077
Ebina H, Misawa N, Kanemura Y, Koyanagi Y, 2013, Harnessiong the CRISPR-Cas9 system to disrupt latent HIV-1 provirus, Sci Rep, 3:2510
Fok WC, Niero ELO, Dege C, et al. 2017, p53 mediates failure of human definitive hematopoiesis in dyskeratosis congenita, Stem Cell Reports, 9(2): 409-418
Huang X, Zhou G, Wu W, et al. 2017, Genome editing abrogates angiogenesis in vivo, Nature Communications, 8(1), 112
Jinek M, Chylinski K, Fonfara I, et al. 2012, A programmable dual RNA-guided DNA endonuclease in adaptive bacterial immunity, Science, 337: 816-821
Manguso RT, Pope HW, Zimmer MD, et al. 2017, In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target, Nature, 547 (7664): 413-418
Marrafiini LA, Sontheimer EJ, 2008, CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA, Science, 322: 1843-1845
Wee SL, 2019, Chinese Scientist Who Genetically Edited Babies Gets 3 Years in Prison, The New York Times (link: https://www.nytimes.com/2019/12/30/business/china-scientist-genetic-baby-prison.html)
Xiao Q, Guo D, Chen S, 2019, Application of CRISPR-Cas9-based gene editing in
HIV-1/AIDS therapy, Frontiers in Cellular and Infection Microbiology, 9:69
Ye L, Wang J, Beyer AI, et al. 2014, Seamless modification of wild-type induced pluripotent stem cell to the natural CCR5Delta32 mutation confers resistance to HIV infection, Proc Natl Acad Sci USA, 111: 9591-9596
Zhan T, 2018, CRISPR-Cas9 for cancer research and therapy, Seminars in Cancer Biology