Metabolizam etanola i posljedice alkoholizma
Nisam toliko popio, ne pijem svaki dan, to nije ništa strašno, pa neću valjda piti mlijeko, to je samo jedan takav dan, tjedan i godina ne nisam alkoholičar niti sam ikada bio ! To su jedne od brojnih opravdanja ljudi kojima je ova naizgled bezopasna supstanca uništila (ili je na putu da uništi) zdravlje, svijest, obitelj ili život.
Potrebno je reći da je alkoholizam ozbiljan poremećaj ovisnosti koji spada u skupinu poremećaja kontrole impulsa – ICD (eng. Impulse control disorder). Dovodi do miliona smrtnih slučajeva godišnje, nasilja u društvu i obitelji, razvoda brakova, maloljetnih delikvencija i naravno prometnih i drugih nesreća. Ozbiljnost ovog problema, debelo je podcijenjena u našem društvu. Ipak problematika, konkretno u ovom tekstu više je vezana za medicinsko biokemijski aspekt problema, nego psihološki i sociološki, a koji za posljedicu ima kronične bolesti, stanja ili nesreće.
Etanol je mala organska molekula koja je topiva i u lipidima i u vodi. Stoga se pasivnom difuzijom lako apsorbira iz crijeva. Mali postotak unesenog etanola (0% do 5%) ulazi u stanice želučane sluznice gornjeg gastrointestinalnog (GI) trakta (jezik, usta, jednjak i želudac), gdje se metabolizira. Ostatak ulazi u krv. Od toga se 85% do 98% metabolizira u jetri i samo 2% do 10% izlučuje se kroz mokraću.
Glavni put metabolizma etanola u jetri je putem jetrene alkohol dehidrogenaze (ADH), citosolnog enzima koji oksidira etanol u acetaldehid uz redukciju NAD u NADH. Ako se ne ukloni metabolizmom, acetaldehid djeluje toksično u jetri i može ući u krv i ispoljiti toksično djelovanje u drugim tkivima. Otprilike 90% acetaldehida koji se stvara dalje se metabolizira do acetata u jetri. Glavni uključeni enzim je mitohondrijska acetaldehid dehidrogenaza (ALDH), koja oksidira acetaldehid u acetat sa stvaranjem NADH . Acetat, koji nema toksične učinke, može se aktivirati u acetil koenzim A (acetil-CoA) u jetri (gdje može ući ili u ciklus trikarboksilne kiseline [TCA] ili u put za sintezu masnih kiselina).
Drugi glavni put oksidacije etanola u jetri je mikrosomalni etanol oksidacijski sustav (MEOS), koji također oksidira etanol u acetaldehid. Glavni uključeni mikrosomalni enzim je citokrom P450 oksidazni izozim s miješovitom funkcijom (CYP2E1), koji koristi NADPH kao dodatni donor elektrona i kisik kao akceptor elektrona. Ovaj put čini samo 10% do 20% oksidacije etanola kod umjerene konzumacije alkohola. Kod povećanog konzumiranja ovaj put postaje aktivniji.
ADH postoji kao obitelj izoenzima s različitom specifičnošću za duljinu lanca alkoholnog supstrata. Etanol je mala molekula koja ne pokazuje mnogo jedinstvenih strukturnih karakteristika i pri visokim koncentracijama, mnogi članovi obitelji ADH ga nespecifično metaboliziraju.ADH koji pokazuju najveću specifičnost za etanol članovi su obitelji ADH1. Imamo tri gena za ovu obitelj ADH, od kojih svaki postoji kao alelne varijante (polimorfizmi)
Acetaldehid se oksidira u acetat uz stvaranje NADH acetaldehid dehidrogenazama. Više od 80% oksidacije acetaldehida u ljudskoj jetri normalno je katalizirano mitohondrijalnom acetaldehid dehidrogenazom (ALDH2), koji ima visok afinitet za acetaldehid i vrlo je specifičan. Međutim, osobe s alelnom varijantom ALDH2 (označene kao ALDH2*2) imaju znatno smanjeni kapacitet za metabolizam acetaldehida .
Dakle, postoje individualne varijacije kada je u pitanju metabolizam alkohola. To uključuje: genotip, polimorfizme ADH i ALDH, historije konzumacije nivoi gastrične (nivoi gastrične ADH opadaju, a CYP2E1 se povećava), spol; nakon konzumiranja etanol u krvi kod žena je viši nego kod muškaraca, te naravno količina ingestiranog alkohola ( preporučena doza dnevno 1-2 piće 0.3 - 0.5 l piva ili 1.5- 0.3 ml vina).
Energija (prinos adenozin trifosfata - ATP) od oksidacije etanola u acetat varira ovisno o putu metabolizma etanola. Ako se etanol oksidira glavnim putem citosolnog ADH i mitohondrijske ALDH, jedan citosolni i jedan mitohondrijski NADH se stvaraju s maksimalnim prinosom od 5 ATP. Oksidacija acetil-CoA u TCA ciklusu i oksidativnoj fosforilaciji dovodi do stvaranja 10 visokoenergetskih fosfatnih veza. Međutim, aktivacija acetata u acetil-CoA zahtijeva dvije visokoenergetske fosfatne veze (jednu u cijepanju ATP-a na adenozin monofosfat (AMP) pirofosfat i jednu u cijepanju pirofosfata u fosfat), koje se moraju oduzeti. Dakle, maksimalni ukupni prinos energije je 13 mola ATP-a po molu etanola.
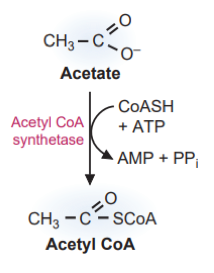
Nasuprot tome, oksidacija etanola u acetaldehid pomoću CYP2E1 troši energiju u obliku NADPH, što je ekvivalentno 2,5 ATP. Dakle, za svaki mol etanola koji se metabolizira ovim putem može se proizvesti najviše 8,0 mola ATP-a.
Visok razmjer NADH/NAD, do kojeg dolazi u putevima metabolizma etanola može se odraziti na metabolizam različitih jedinjenja. Tako dolazi do inhibicije oksidacije masti te njihove akumulacije što dovodi do povišenog VLDL u krvi, te pojave masne jetre. Također budući da je oksidacijom alkohola stvoreno dovoljno NADH, acetil CoA nema potrebe ulaziti u Krebsov ciklus (TCA), te ulazi u puteve stvaranja ketonskih tijela, što dovodi do ketoacidoze. Visok odnos NAD/NADH inhibira i glukoneogenezu tokom gladovanja, što dovodi do hipoglikemije, te glikolizu nakon obroka, što dovodi do hiperglikemije. Tu je i acetaldehid kao nusprodukt koji se veže za životno važne proteine, shodno tome jetra mora ubrzano da sintetiše proteine, te dolazi do njihove akumulacije .
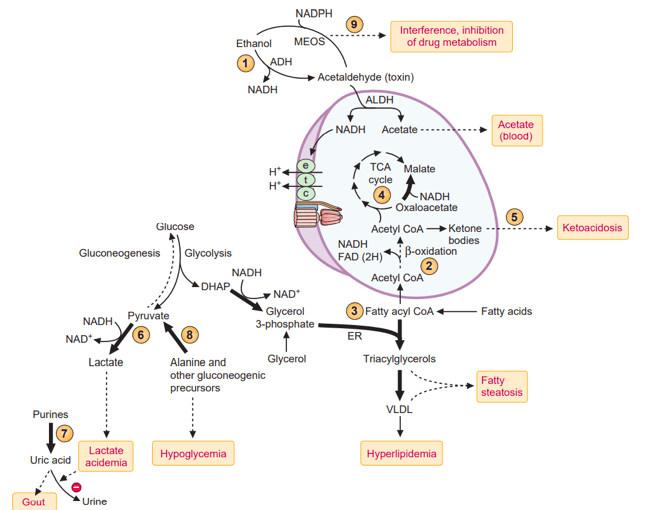
Akumulacija proteina rezultira priljevom vode unutar hepatocita i oticanje jetre koje doprinosi portalnoj hipertenziji i poremećaju arhitekture jetrenog parenhima . Jedan od zahvaćenih proteina je glutation koji je antioksidans što pogoduje stvaranju reaktivnih jedinjenja i oksidativnom stresu.
Također zbog toga povećana i hronična konzumacija alkohola dovodi do niza metaboličkih poremećaja što na kraju rezultira ozbiljnom bolešću. Kao što je spomenuto alkoholom izazvana bolest jetre, česta i ponekad smrtonosna posljedica kronične zlouporabe etanola, može se manifestirati u tri oblika: masna jetra, alkoholom izazvan hepatitis i ciroza.
Acetaldehid i slobodni radikali nastali metabolizmom etanola mogu rezultirati alkoholom izazvanim hepatitisom, stanjem u kojem je jetra upaljena i stanice postaju nekrotizirane i umiru. Difuzno oštećenje hepatocita rezultira cirozom koju karakterizira fibroza (ožiljci), poremećaj normalne arhitekture i protoka krvi, gubitak funkcije jetre i konačno, zatajenje jetre.
Tijekom razvoja ciroze gube se mnoge normalne metaboličke funkcije jetre, uključujući biosintetske putove i putove detoksikacije.
Sinteza bjelančevina krvi uključujući faktore zgrušavanja krvi i serumski albumin je smanjena. Sposobnost ugradnje amino skupina u ureu je smanjena, što rezultira nakupljanjem toksičnih razina amonijaka u krvi.
Konjugacija i izlučivanje žutog pigmenta bilirubina(proizvod razgradnje hema) se smanjuje, a bilirubin se nakuplja u krvi. Taloži se u mnogim tkivima, uključujući kožu i bjeloočnicu, zbog čega pacijent postaje vidljivo žut, također je izrazito toksičan.
Osim jetre alkohol također oštećuje i mozak, alkohol podiže nivo endorfina koji se vezuju na receptore za opijate, te pretjerano konzumiranje alkohola može dovesti do demencije i drugih neuroloških poremećaja. Alkohol se također vezuje za GABA receptore u mozgu te prilikom apstinencije kod hroničnih alkoholičara dolazi do disregulacije ovih receptora i stanja poznatog kao delirium tremens. Također znanstvenici su otkrili da kod mladih osoba koji umjreno piju ali često dolazi do poremećaja u hipokampusu što može dovesti kasnije do kognitivnih poremećaja.
Tijekom kronične konzumacije alkohola, sve više i više alkohola je potrebno za oslobađanje neurotransmitera dopamina što s godinama dovodi do pada nivoa dopamina u mozgu , te kao posljedica do depresije, slabosti, gubitka pamćenja, agresivnosti i raznih neuroloških poremećaja.
Marks Basic Medical Biochemistry,4 th Edition 2012 Lieberman M, Marks A, Peet A