Alzheimerova bolest
U svega 1% oboljelih, uzrok Alzheimerove bolesti povezan je sa mutacijama tri funkcionalno slična membranska proteina i to: β-amiloid prekursorski protein (APP), presenilin 1 (PS1) i presenilin 2 (PS2).
Jako je važno istaći da osobe sa Downovim sindromom (trizomija 21) takođe razvijaju rani oblik Alzheimerove bolesti što je povezano sa još jednom, dodatnom kopijom APP gena, lociranog na hromozomu 21.
Iako je uzrok sporadičnog oblika nepoznat, defekti gena u familijarnim oblicima ove bolesti ukazuju na ulogu APP-a, proteina sa neurotrofičnim svojstvima, ali i presenilina koji su uključeni u njegov metabolizam.
Nasuprot genima čije mutacije uzrokuju Alzheimerovu bolest, normalni polimorfizam gena koji kodira apolipoprotein E (APOE) značajno utiče na rizik od buduće pojave ove bolesti. Apolipoprotein E je protein koji učestvuje u transport holesterola i u normalnoj populaciji postoje tri alela i to: ε2, ε3 i ε4. Osobe koje imaju jedan APOE-ε4 (heterozigoti za APOE-ε4) su u 2-3 puta većem riziku da će oboljeti od Alzheimerove bolesti a osobe sa obe kopije APOE-ε4 su u 10-11 puta većem riziku da obole od ove bolesti. Takođe, kod tih osoba ova bolest počinje ranije. Jako je važno napomenuti da APOE-ε4 predstavlja gen podložnosti a ne gen koji izaziva bolest, jer od Alzheimerove bolesti obolijevaju i osobe bez ovog alela, dok čak i homozigoti za APOE-ε4 alel mogu biti bez ikakvih znakova demencije do duboke starosti.
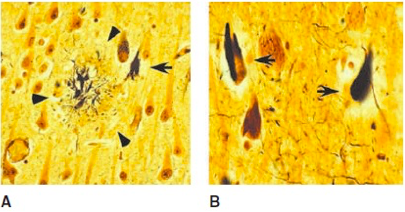
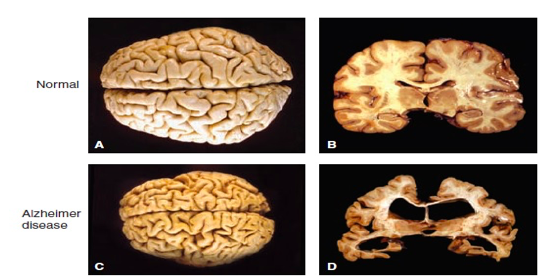
Neuritski plakovi su ovalne mikroskopske lezije u ekstracelularnom prostoru mozga čiju strukturu čini centralno proteinsko jezgro sastavljeno od fibrilarnog proteina β-amiloidnog peptida (Aβ) koje je okruženo distrofičkim nervnim završecima. Takođe ovi proteini talože se i u krvnim sudovima mozga i moždanih ovojnica oboljelih od Alzheimerove bolesti.
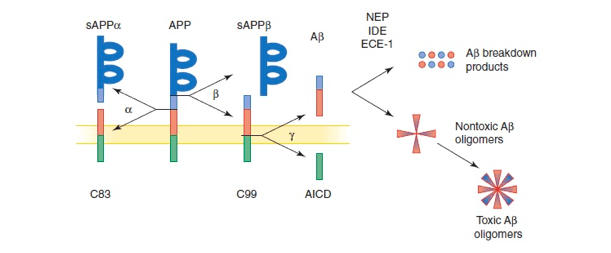
Aβ je protein koji se sastoji od 38 do 43 aminokiseline, a predstavlja produkt proteolitičke razgradnje APP-a, transmembranskog proteina. U normalnim okolnostima, razgradnju APP-a vrši enzim α-sekretaza kojom se ne produkuje Aβ jer ovaj enzim siječe APP baš unutar sekvence Aβ . Enzim β-sekretaza na čiju se funkciju nadovezuje nekoliko γ-sekretaza vrši oslobađanje upravo sekvence Aβ koja sadrži 40 do 42 aminokiseline (kratka i duga forma). Upravo oslobađanjem ovih formi a posebno duge forme, dolazi do stvaranja oligomera sa drugim peptidima i nagomilavanja amiloida u formi neuritskih plakova. Presenilin 1 i 2 doprinose uticaju γ-sekretaze (Slika 2.).
Obično neravnoteža između djelovanja α-sekretaze i β-sekretaze u korist β-sekretaze uzrokuju formiranje ovih plakova koji dalje djeluju neurotoksično dovodeći do apoptoze, oksidativnog stresa itd.
3. Tau protein i neurofibrilarna klubad
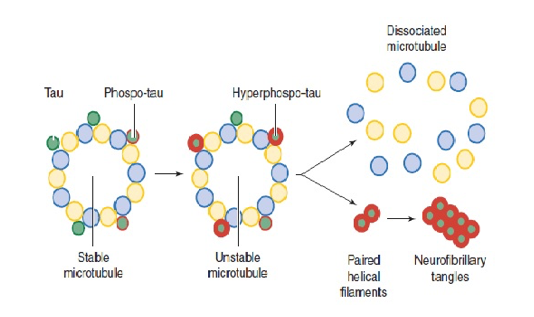
Tau protein je citoplazmatski protein koji se veže za tubulin i vrši stabilizaciju mikrotubula, citoskeletnih struktura koje su zadužene za očuvanje ćelijskog integriteta i koje omogućavaju normalan intraćelijski transport.
U Alzheimerovoj bolesti tau protein postaje hiperfosforilisan i dolazi do njegove disocijacije od mikrotubula pri čemu takvi hiperfosforilisani tau proteini stvaraju agregate formirajući neurofibrilarnu klubad (Slika 3.). Pretpostavlja se da ove strukture dovode do poremećaja u aksonalnom transportu.
Gore navedene promjene koje obuhvataju genetiku, neuritske plakove i neurofibrilarnu klubad zajedno će dovesti do:
- neuronske i sinaptičke disfunkcije – Alzheimerova bolest je povezana sa ranim promjenama u sinaptičkoj funkciji koje obuhvataju izmijenjenu ekscitatornu funkciju, gubitak dendrita i posljedični gubitak sinapsi u nervnom sistemu. Ove promjene remete interneuronalnu konekciju i brojne neurotransmiterske funkcije kao što su: acetilholinska, noradrenalinska, dopaminska, serotoninergička, glutamatna itd.). Svi ovi gubici mogu pomoći u objašnjenju zašto kod ovih bolesnika dolazi do gubitka pamćenja i i kognitivnih oštećenja.
- gubitak neurona i moždana atrofija – Određena populacija neurona oboljelih od ove bolesti je praktično izgubljena, posebno onih sa glutamatnom aktivnošću u hipokampusu ali i holinergičkih neurona u bazi frontalnog režnja. Fokalne atrofije mogu se jasno vidjeti u pogođenih regijama mozga (Slika 4.).
- vaskularni poremećaji – U suštini teorija uključenosti vaskularnih poremećaja u patogenezu ove bolesti jako je diskutabilna. Sa sigurnošću možemo reći da su osobe sa određenim APOE genotipom podložnije ovoj bolesti, ali opet sa druge strane ne možemo sa sigurnošću reći da će ove osobe nužno oboljeti od Alzheimerove bolesti i pored ove predispozicije.
Klinička progresija Alzheimerove bolesti obuhvata presimptomatsku fazu koja može trajati i preko 10 godina za koju je karakteristično nagomilavanje amiloidnih plakova na koju se nastavlja simptomatska faza koja traje i do 10 godina tokom koje se javljaju i neurofibrilarna klubad.
Termin blago kognitivno oštećenje (eng. mild cognitive impairment – MCI) se ponekad koristi da bi se opisala rana faza pada kognitivne funkcije posmatrana kod bolesnika koji kasnije dobiju dijagnozu Alzheimerove bolesti. Poremećaj pamćenja, posebno za skorašnje događaje predstavlja jedan od prvih simptoma ove bolesti, obično vidljiv od strane članova porodice. Kako poremećaji pamćenja napreduju mjesecima i godinama, bolesnici prvo postaju izgubljeni u vremenu a potom i u prostoru. Afazija, anomija (oblik afazije u kojem bolesnik ne može da imenuje predmete iz svakodnevnog života) i akalkulija se mogu razviti a tjeraju bolesnika da napusti posao ili ga onemogućavaju da vrši svakodnevne aktivnosti u porodičnom okruženju. Depresija sa apatijom i anksioznošću može rano da se ispolji i nije u korelaciji sa težinom kognitivnog osiromašenja. Apraksija i vidnoprostorna orijentacija dovode do toga da bolesnik vrlo brzo postane izgubljen u vremenu i prostoru. Primitivni refleksi su obično vidljivi. Poremećaj hoda pod uticajem frontalnog režnja može biti uočljiv u vidu kratkog, sporog hoda, bolesnik vuče nogu jednu za drugom, sa fleksijom tijela prema naprijed i poteškoćama u započinjanju hoda.
U kasnim fazama, prethodno očuvani socijalni kontakti su izgubljeni, psihijatrijski simptomi se već uveliko javljaju uključujući psihoze sa paranojama, iluzije i halucinacije. Pregledom ovih bolesnika može se uočiti i rigidnost i bradikinezija. Rijetko i obično u kasnim fazama bolesti javljaju se i
mioklonus, inkontinencija, spasticitet ali nekad čak i hemipareze.
Mutizam, inkontinencija i “prikovanost” za krevet su terminalne manifestacije. Nemogućnost samostalnog uzimanja hrane, febrilne epizode, dispneja, pneumonija i jaki bolovi su uobičajene komplikacije u zadnjim mjesecima života i smrt nastupa za 5 do 10 godina od početka simptoma (Tabela 1).
5. Dijagnoza Alzheimerove bolesti
Prvo pravilo je da je Alzheimerova bolest klinička dijagnoza! Ne postoji niti jedan pojedinačni simptom ili znak bolesti u kliničkoj slici koji je specifičan za ovu bolest već se mora analizirati cjelina anamnestičkih i kliničkih podataka (Tabela 1.)
Drugo pravilo je da ne postoji niti jedan laboratorijski, neurofiziološki ili radiološki test ili metod kojim se dijagnoza Alzheimerove bolesti može sa 100% sigurnošću postaviti, pa je njihova uloga prvenstveno u isključivanju drugih diferencijalno dijagnostičkih mogućnosti.
1. Laboratorijska dijagnostika
Ova dijagnostika se obično koristi da bi isključila druge poremećaje. Pretrage koje bi mogle da pomognu u postavljanju dijagnoze Alzheimerove bolesti uključuju analizu cerebrospinalne tečnosti u kojoj moćemo naći redukovani Aβ42 i povećan tau i fosfo-tau protein.
2. PET CT
Pozitronska emisiona tomografija mozga sa ligandom koji obilježava prisustvo β-amiloida danas se široko koristi.
3. Magnetna rezonanca
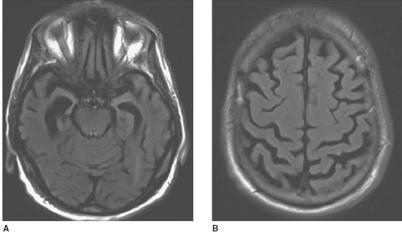
Ovom metodom prikazuju se medijalni temporalni režanj (uključujući hipokampus) koji je često zajedno sa parijetalnim često više atrofičan u odnosu na frontalni režanj (Slika 4.).
6. Diferencijalna dijagnoza
U diferencijalnoj dijagnozi i to u ranim fazama Alzheimerova bolest može ukazati na depresiju ili poremećaje pamćenja kao što je sindrom Korsakovljeve amnezije.
U postavljanju dijagnoze Alzheimerove bolesti najvažnije je isključiti sljedeća oboljenja i sindrome:
frontotemporalnu demenciju, demenciju sa Lewyjevim tijelima, vaskularna demencija, Creutzfeldt-Jacobsovu demenciju itd.
Do sada nije otkriven niti jedan odgovarajući lijek ili metod liječenja kojim bi se smanjili ili uklonili postojeći neurološki deficiti ili da bi se spriječila progresija bolesti.
Sa farmakološke tačke gledišta posebno je važno smanjenje aktivnosti
enzima holin acetiltransferaze,
enzima koji vrši sintezu acetilholina, u kori mozga i hipokampusu. Ovaj enzim se nalazi u holinergičkim neuronima i opisani pad njegove aktivnosti posljedica je izumiranja holinergičkih neurona u bazoseptalnim jedrima a posebno u
nucleus basalis – Meynert, koji se projektuju ka kori mozga gdje oslobađaju acetilholin. Utvrđeno je da težina kognitivnog oštećenja, posebno u domenu pamćenja, korelira sa gubitkom neurona u Meynertovom jedru i sa padom aktivnosti enzima holin acetiltransferaze u kori mozga. To je bila osnova terapijskih pokušaja da se kognitivni poremećaji poprave primjenom inhibitora acetilholinesteraze, enzima koji razgrađuje acetilholin.
Ipak, terapija Alzheimerove bolesti sastoji se iz:
a) neuroprotektivne terapije
- koristimo antioksidativne lijekove i
b) simptomatske terapije
– kojom pokušavamo da kontrolišemo kognitivne al ii psihijatrijske smetnje i poremećaje ponašanja (Tabela 2.).
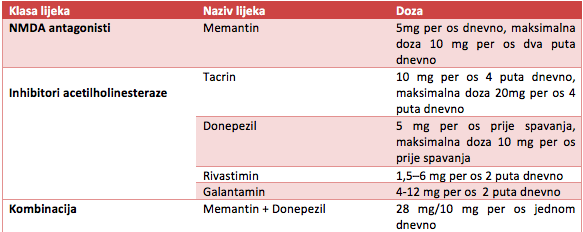
Obzirom na već opisanu ulogu holinergičkog sistema, uvedena je terapija inhibitorima acetilholinesteraze, sa idejom da se smanji razgradnja acetilholina i produži njegovo djelovanje na holinergičke sinapse u kori mozga. Ti lijekovi su: tacrin, donepezil, rivastigmin i galantamin.
Od ostalih lijekova primjenjuju se i antagonisti N-methyl-D-aspartatnih (NMDA) glutamatnih receptora, a najpoznatiji lijek iz ove grupe je
memantin. U liječenju depresije koriste se antidepresivi bez ili sa malim antiholinergičkim efektima dok se antipsihotici, anksiolitici i antikonvulzivi koriste u terapiji psihoza i stanja agitiranosti.
REFERANCE
1. Simon P. R., Aminoff J. M., Greenberg A. D., Clinical neurology, 10th edition, New York, McGraw-Hill Education/Medica, 2018.
2. Budson E. A., Solomon R. P., Memory Loss, Alzheimer’s disease and Dementia: A Practical Guide for Clinicians, 2nd edition, Edinburgh, Elsevier, 2015.
3. Hooper N.M., Alzheimer’s disease, 1st edition, New Jersey, Humana press, 2010.
4. Kostić V., Neurologija za studente medicine, Beograd, Medicinski fakultet u Beougradu, 2016.