ACIDOBAZNI STATUS I ACIDOBAZNA RAVNOTEŽA
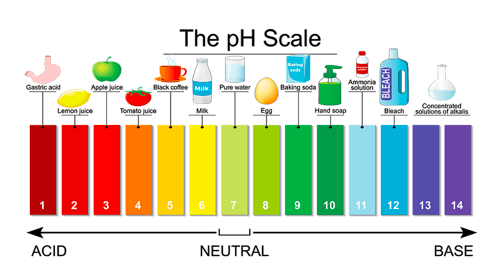
Za normalno funkcionisanje organizma je potrebna i optimalna, odnosno neutralna pH sredina. Međutim, mi u organizam svakodnevno unosimo različite vrste hrane i pića kiselog ili alkalnog karaktera, dok s druge strane metabolički putevi u organizmu dovode do nastajanja ugljične, fosforne, sumporne i drugih kiselina. U toku 24h izdahne se oko 20 mol CO2 putem respiratornog sistema i oko 70-100 mmol kiselina se izluči putem bubrega ali to ipak ne dovodi do promjene u pH.
Sada se postavlja logično pitanje. Kako organizmi čiji organski sistemi zahtjevaju gotovo neutralni pH, unose kisele i alkalne supstance( npr. čovjek koji pije sok od narandže koji ima pH 2,5 do 3,0) i kako mogu preživjeti? Odgovor su puferi.
Hajde onda da krenemo redom.
Koncentracije vodonikovih jona (H+)
Vodonikov jon je pojedinačni slobodni proton oslobođen iz vodonikovog atoma. Vrlo precizna regulacija koncentracije vodonikovih jona je od izrazite važnosti jer se većina aktivnosti svih enzimskih sistema u organizmu odvija pod utjecajem koncentracije vodonikovih jona. Shodno tome, bilo kakve promjene koncentracije vodonikovih jona će utjecati na rad skoro svih ćelija i organskih sistema.
Koncentracija H+ jona se u tjelesnim tečnostima fiziološki održava na veoma niskom nivou u poređenju sa koncentracijama drugih jona. Npr. normalna koncentracija Na+ u ekstracelularnoj tečnosti iznosi 142 mmol/l te je ona oko 3,5 miliona puta veća od normalne koncentracije H+ jona koja iznosi oko 0,00004 mmol/l. Dakle, ako posmatramo ovako nisku koncentraciju jona vodonika i njihov značaj kod promjene pH vrijednosti, možemo zaključiti da je precizna regulacija promjene koncentracije vodonikovih jona veoma važna za održavanje fizioloških procesa u organizmu.
Na koji način se vrši regulacija aktivnosti odnosno koncentracije H+ jona u organizmu?
Normalan pH arterijske krvi je 7,40 dok je pH venske krvi i intersticijumske tečnosti oko 7,35 zbog dodatnog ugljen-dioksida (CO2) koji se oslobađa iz tkiva a koji stvara H2CO3, pa prema tome normalan pH krvi je blago alkalan ako posmatramo uopšteno neutralnu pH sredinu od pH 7,0. Međutim, u kliničkoj praksi kako je normalan pH arterijske krvi 7,40 smatra se da osoba ima acidozu kad pH padne ispod ove vrijednosti a alkalozu kad pH poraste iznad 7,40. Donja granica pH vrijednosti sa kojom osoba može da preživi nekoliko sati je 6,80 a gornja granica je oko 8,0. Intracelularni pH je malo niži od pH plazme zbog toga što ćelijski metabolizam proizvodi kiesline, posebno H2CO3. U zavisnosti od vrste ćelije, utvrđeno je da intracelularni pH može da varira od 6,0 do 7,4. Hipoksija i smanjen protok krvi kroz tkiva mogu dovesti do nagomilavanja kiselina i snižavanja pH vrijednosti u ćelijama.
pH mokraće varira od 4,5 do 8,0 u zavisnosti od acidobaznog stanja ekstracelularne tečnosti. Vidjet ćemo kasnije kakvu to ulogu imaju bubrezi u regulaciji pH.
Primjer ekstremno kisele tjelesne tečnosti je HCl koju luče parijetalne ćelija želuca. Koncentracija H+ jona u ovim ćelijama je 4 miliona puta veća od koncentracije H+ jona u krvi i njihov pH iznosi 0,8.
Sve što nepovoljno utječe na krvotok pojedinca, negativno će utjecati i na zdravlje te osobe zbog toga što krv djeluje kao puferski rastvor koji održava sve tjelesne ćelije i tkiva u ravnoteži. Acidobazna homeostaza tiče se pravilne ravnoteže između kiselina i baza. Organizam čovjeka je vrlo osjetljiv na promjene nivoa pH pa postoje snažni mehanizmi za njegovo održavanje. Izvan prihvatljivog raspona pH, proteini se denaturiraju i probavljaju, enzimi gube sposobnost funkcionisanja i u krajnjem slučaju može nastupiti smrt.
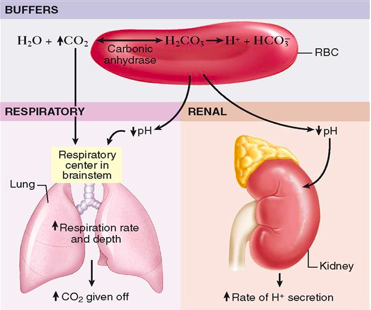
Postoje 3 sistema regulacije aktivnosti H+ jona u organizmu:
- Puferski sistemi krvi
- Respiratorni mehanizmi
- Renalni mehanizmi
Šta je pufer?
Prva linija odbrane jesu različiti hemijski puferi. Puferi su hemijske supstance koje minimiziraju promjenu pH. Pufer je otopina slabe kiseline i njene konjugovane baze. U krvi je glavni puferski sistem slaba kiselina, ugljična kiselina (H2CO3) i njena konjugovana baza, bikarbonat (HCO3–). Kada postoji promjena koncentracije H+ jona, puferski sistemi tjelesnih tečnosti reaguju veoma brzo kako bi umanjili te promjene. Puferski sistemi ne uklanjaju H+ iz organizma niti ih dodaju, nego ih samo drže čvrsto vezane dok se ravnoteža ponovo ne uspostavi.
pH puferske otopine se vrlo malo mijenja kada mu se doda mala količina jake kiseline ili baze, uopšteno, puferi najbolje rade u onom pH intervalu koji je ±1 pH jedinicu od njihovog pK, što znači da je odnos komponenti manji od 10:1.
pK predstavlja negativni logaritam konstante disocijacije kiseline. To znači da je pK onaj pH na kojem su, za dati pufer, kiselina i njena konjugovana baza u jednakim koncentracijama.
Puferske otopine koriste se kao sredstvo za održavanje pH vrijednosti na gotovo konstantnom nivou u širokom spektru hemijskih promjena. Jedan od primjera puferskog rastvora koji se nalazi u organizmu čovjeka je krv. Postoji nekoliko puferskih sistema koji reverzibilno vezuju jone vodonika i ometaju bilo kakvu promjenu pH.
Najvažniji fiziološki puferski sistemi su oni u plazmi i eritrocitima:
1. Bikarbonat/ugljična kiselina
2. Fosfatni puferski sistem
3. Proteini plazme i hemoglobinski puferski sistem
Ekstracelularni puferi uključuju bikarbonat i amonijak, dok fosfati i proteini djeluju kao intracelularni puferi.
- Bikarbonatni puferski sistem
Ovo je najvažniji je puferski sistem plazme, prisutan je i u eritrocitima, ali u manjoj koncentraciji. Iako je pK 6,1 a odnos baza/kiselina=20:1, vrlo je efikasan iz dva razloga:
● Visoka koncentracija (> 20 mmol/L)
● pCO2 se može veoma brzo regulisati
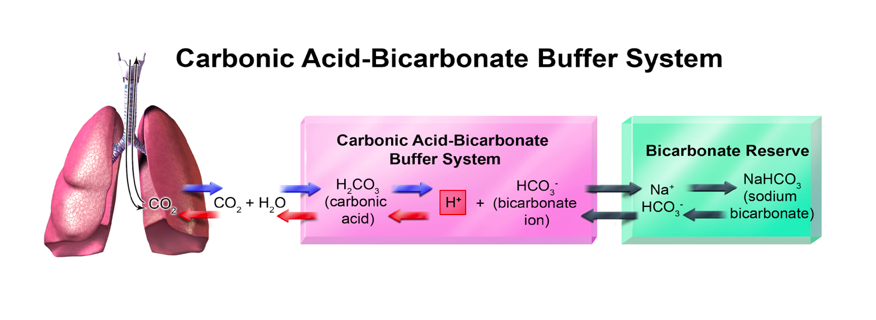
Pored toga, stepen reapsorpcije HCO3- u bubrezima se takođe može mijenjati. Puferski sistem bikarbonata je posebno ključan, jer se ugljen dioksid (CO2) može prebaciti kroz ugljičnu kiselinu (H2CO3) na vodonikove jone i bikarbonat.
(HCO3−) : H2O + CO2 ⇋ H2CO3 ⇋ H+ + CO3-
2. Fosfatni puferski sistem
Na pH 7,4 odnos HPO42 - / H2PO4- je 4:1 (pK=6,8).
Ukupna koncentracija fosfatnog pufera u plazmi i u eritrocitima je veoma niska (samo 5% puferskog kapaciteta plazme). Organski fosfati (2,3-bisfosfoglicerat) koji su prisutni u eritrocitima, doprinose sa oko 16% puferskom kapacitetu krvi.
3. Proteini plazme i hemoglobinski puferski sistem
Puferska vrijednost nebikarbonatnih puferskih sistema u plazmi je oko 7,7 mmol/L na pH 7,4. Najveći dio čine proteini (95%). Najvažnije grupe u proteinima su imidazolove grupe histidina (albumin ih ima 16).
Puferska vrijednost nebikarbonatnih pufera u eritrocitima je 63 mmol/L na pH 7,2. Najveći dio čini hemoglobin (53 mmol/l) a ostatak 2,3 bisfosfoglicerat. Najvažnije grupe su imidazolove grupe u hemoglobinu.
Zanimljivo je još spomenuti da kost također postaje važan pufer nakon potrošnje ekstracelularnog HCO3–. U početku oslobađa NaHCO3 i KHCO3 u zamjenu za H+, dok pri produženom opterećenju kiselinom otpušta CaCO3 i CaHPO4. Dugotrajna acidemija prema tome pridonosi i demineralizaciji kosti i osteoporozi.
Primjer vještačkih pufera su antacidi koji se bore protiv viška želučane kiseline. Mnogi lijekovi djeluju slično puferima, često s barem jednim jonom (obično karbonatom) koji može apsorbirati vodik i regulisati pH, donoseći olakšanje onima koji pate zbog želučanih tegoba nakon jela.
Acidobazni poremećaji koji prevazilaze puferski sistem mogu se kompenzovati u kratkom roku promjenom brzine ventilacije. To mijenja koncentraciju ugljen dioksida u krvi i pomiče gornju reakciju prema Le Chatelierovom principu, što zauzvrat mijenja pH. Također, pored respiratornog sistema ulogu u kompenzaciji promjena imaju i bubrezi metaboliziranjem HCO3.
ULOGA PLUĆA U REGULACIJI ACIDO BAZNE RAVNOTEŽE
Broj respiracija u minuti iznosi 12-16, što znači da se izmijeni oko 6-8 L vazduha. Fizička aktivnost povećava brzinu ventilacije i u toku napora broj respiracija može da se poveća 20-30 puta u odnosu na mirovanje ali je to vrlo kratkotrajno.
Nevoljne promjene dubine i frekvencije disanja kontroliše respiratorni centar i hemoreceptori u karotidnim arterijama i aorti. Oni su stimulisani padom pH usljed nagomilavanja CO2 ili smanjenja O2.
Respiratorni sistem trenutno reaguje na promjene acidobaznog statusa, ali je potrebno nekoliko minuta pa i sati da dođe do maksimalnog odgovora. Maksimalan odgovor podrazumijeva maksimalnu stimulaciju i perifernih i centralnih hemoreceptora. Respiratorni hemoreceptori u moždanom stablu reaguju na promjene u koncentraciji ugljen dioksida u krvi, uzrokujući povećanu ventilaciju (disanje) ako koncentracija ugljen dioksida poraste i smanjenu ventilaciju ako koncentracija ugljen dioksida padne.
Konstantna koncentracija CO2 u krvi, neophodna za održavanje normalne acidobazne ravnoteže, odražava ravnotežu između one koncentracije koja nastaje kao rezultat metabolizma ćelija i one koja se plućima izbacuje zrakom tokom ekspirijuma.
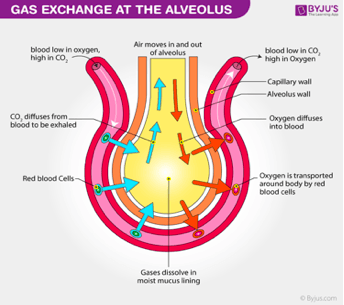
Prilagođavajući brzinu izbacivanja ugljen dioksida, pluća regulišu sadržaj ugljen dioksida u krvi. Slijed događaja od stvaranja ugljen dioksida u tkivima do eliminacije u izdahnutom vazduhu opisan je na Ilustraciji 5.
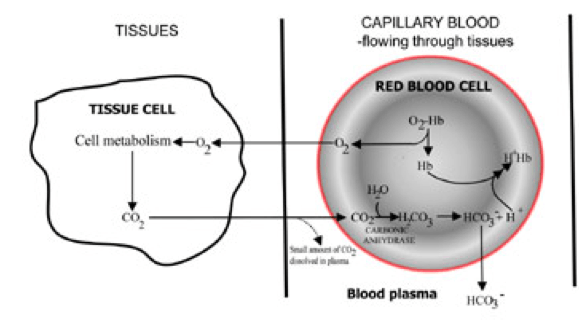
Ugljen dioksid difunduje iz ćelija u okolnu kapilarnu krv. Mali dio otapa se u krvnoj plazmi i nepromijenjen transportuje do pluća. Ali, većina difunduje u crvene krvne ćelije gdje se kombinuje s vodom i stvara ugljičnu kiselinu. Kiselina disocira stvarajući vodonikove jone i bikarbonat (Ilustracija 6.). Dalje, vodonikovi joni se kombinuju s deoksigeniranim hemoglobinom (hemoglobin ovdje djeluje kao pufer), sprečavajući veliki pad ćelijskog pH a bikarbonat difunduje duž gradijenta koncentracije od crvenih krvnih zrnaca do plazme. Tako se većina ugljen dioksida proizvedenog u tkivima transportuje u pluća kao bikarbonat u krvnoj plazmi.
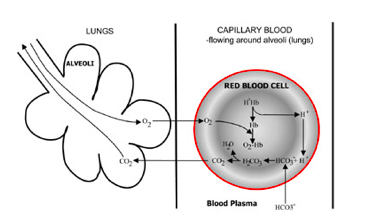
U plućnim alveolama proces je obrnut (Ilustracije 6. i 7.). Joni vodonika se istiskuju iz hemoglobina jer hemoglobin sad veže kisik iz udahnutog vazduha. Jone vodonika sada puferira bikarbonat koji iz plazme difunduje nazad u crvene krvne ćelije i stvara se ugljična kiselina. Kako njena koncentracija raste ona se onda pretvara se u vodu i ugljen dioksid. Konačno, ugljen dioksid difunduje duž koncentracijskog gradijenta od crvenih krvnih zrnaca do alveola kako bi se izlučio u izdahnutom zraku.
U uslovima kada je razmjena gasova kompromitovana, nagomilava se ugljen dioksid. Višak molekula CO2 sa vodom daju ugljičnu kiselinu, što dovodi do snižavanja pH. Terapijski pristup, ukoliko ostale mjere ne daju rezultate je da se snizi pCO2 asistiranom ventilacijom.
Dakle, respiratorni sistem učestvuje u regulaciji pH vrijednosti regulacijom koncentracije CO2 na način da podešava dubinu i učestalost disanja. Snižavanje pH, dakle, registruju arterijski hemoreceptori koji kao odgovor dovode do povećanja dubine i broja respiracija i kada se CO2 izdahne pH krvi poraste. U odnosu na hemijsko puferiranje, učinkovitost plućnog puferiranja je 50–75% i ne može potpuno normalizirati pH krvi.
Budući da je održavanje normalnog pH vitalno za život a i da pluća igraju ključnu ulogu u održavanju normalnog pH, pušači imaju još jedan razlog za odvikavanje od pušenja.
ULOGA BUBREGA U REGULACIJI ACIDOBAZNE RAVNOTEŽE
Prosječan pH plazme i inicijalnog glomerularnog filtrata je oko 7,4 dok je pH urina prosječno 6,0 (ali se kreće od 4,5 do 8,0) što nam govori o tome da bubrezi mogu učestvovati u eliminaciji neisparljivih kiselina iz organizma jer pH urina može varirati od 4,5-8,0. Mnoge kiseline koje nastaju u metaboličkim procesima budu neutralisane u ekstracelularnoj tečnosti na račun HCO3-. Dakle, bubrezi pomažu u održavanju acidobazne ravnoteže izlučivanjem vodonikovih jona u urin i reapsorpcijom bikarbonata iz urina. Ove promjene nastupaju satima pa i danima nakon promjene acidobazne ravnoteže.
Izlučivanje kiselina putem bubrega i čuvanje HCO3- se odvija pomoću nekoliko mehanizama:
1. Izmjena Na+ / H+ jona
2. Sinteza amonijaka i izlučivanje NH4+ i hidrogen-fosfata
3. Vraćanje bikarbonata iz glomerularnog filtrata
Ćelije bubrežnih tubula bogate su enzimom karboanhidrazom koji olakšava stvaranje ugljične kiseline iz ugljen dioksida i vode. Ugljična kiselina disocira na bikarbonatne i vodonikove jone. Bikarbonat se ponovo apsorbuje u krv a joni vodonika prelaze u lumen tubula i urinom se uklanjaju iz tijela. Ova eliminacija iz urina ovisi o prisutnosti pufera, uglavnom fosfatnih i amonijačnih jona.
U fiziološkim uslovima, renalne tubulske ćelije u skoro svim dijelovima nefrona stvaraju i izlučuju vodonikove (H+) jone u intratubulski lumen. Joni vodonika se stvaraju u tubulskim ćelijama disocijacijom ugljične kiseline koja nastaje iz CO2 i H2O u reakciji koju katalizuje karboanhidraza. U lumenu tubula sekretovani H+ joni mogu da reaguju sa HCO3-, amonijakom (NH3 ) ili hidrogen-fosfatom (HPO42-).
Regulacija pH u bubrezima se dakle provodi regulacijom količine reapsorbovanog HCO3– i izlučenog H+, povećanje koncentracije HCO3– analogno je uklanjanju slobodnog H+.
Reapsorpcija HCO3– odvija se uglavnom u proksimalnim tubulima a manjim dijelom i u sabirnim kanalićima. Dolazi do disocijacije vode na H+ i OH–. Pomoću enzima karboanhidraze se OH– veže sa CO2 i stvara HCO3– koja se onda vraća u peritubulske kapilare, dok se H+ luči u lumen tubula i spaja s filtriranim HCO3– pa zatim nastaju CO2 i H2O, koji se isto reapsorbuju. Shodno tome, reapsorbovane čestice HCO3– su tu na novo stvorene, a ne one filtrirane. Porast pCO2 povećava reapsorpciju HCO3–, dok gubitak Cl– potiče reapsorpciju Na+ i stvaranje HCO3– u proksimalnim tubulima.
Kiseline se aktivno seceniraju u proksimalne i distalne tubule i tu se spajaju s urinarnim puferima, prije svega sa slobodno filtriranim HPO4–2, kreatininom, mokraćnom kiselinom i amonijakom, da bi se mogle izlučiti iz tijela. Ovdje je posebno važan puferski sistem amonijaka jer se drugi puferi filtriraju u zadanim koncentracijama i brzo poništavaju jakim kiselinskim opterećenjem, dok se u odgovoru na ovakvo opterećenje amonijak aktivno stvara u ćelijama tubula. Glavnu stanicu izlučivanja kiselina predstavlja arterijski pH ali na ovaj proces utiču i K+, Cl– kao i aldosteron. Koncentracija K+ u ćelijama i izlučivanje H+ su u recipročnom odnosu. Manjak K+ uzrokuje povećanu sekreciju H+ i posljedičnu metaboličku alkalozu.
Ispitivanje urina je važno jer može otkriti acidobazne poremećaje. Npr., nekontrolisani dijabetes rezultira visoko kiselom mokraćom. Ako dijabetes ostane nekontrolisan, bubrezi bi mogli postati preopterećeni i moglo bi doći do poremećaja njihove funkcije, što bi kao posljedicu imalo komu ili smrt.
KLINIČKA MJERENJA I ANALIZA ACIDOBAZNOG STATUSA
Odgovarajuća terapija poremećaja acidobazne ravnoteže prije svega zahtjeva tačnu i preciznu dijagnozu. Za procjenu acidobazne ravnoteže, za početak, ćemo analizarati 3 parametra:
- pH
- koncentraciju bikarbonata plazme
- pCO2
Dijagnoza prostih acidobaznih poremećaja ( metabolička acidoza ili akaloza, respiratorna acidoza ili alkaloza) uključuje nekoliko faza kao što je prikazano na Ilustraciji 9.:
Fiziološke vrijednosti komponenti koje prvo analiziramo su:
→ pH 7,35-7,45
→ pCO2 40 mmHg
→ HCO3- 24 mmol/L
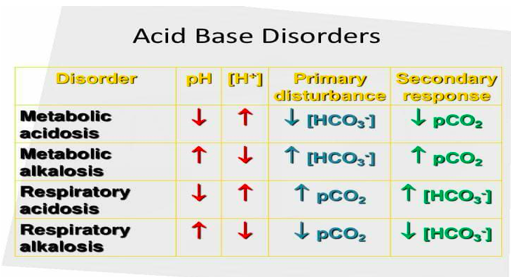
Održavanjem homeostaze i fizioloških vrijednosti navedenih parametara omogućava normalno funkcionisanje samog organizma te će svaka promjena njihovih vrijednosti dovesti i do promjene pH a što će utjecati na funkcionisanje organizma u cjelosti. U zavisnosti od toga koja komponenta je promijenjena, respiratorna ili metabolička, razlikujemo i sljedeće vrste prostih acidobaznih poremećaja:
- Metabolička acidoza ( snižena koncentracija HCO3-)
- Metabolička alkaloza ( povišena koncentracija HCO3-)
- Respiratorna acidoza ( povišena koncentracija CO2)
- Respiratorna alkaloza ( snižene koncentracija CO2)
→ Prvo analiziramo vrijednosti pH.
Ispitivanjem pH krvi može se utvrditi da li je poremećaj acidoza ili alkaloza.
● pH <7,35 govori u prilog acidozi
● pH >7,45 govori u prilog alkalozi.
→ Zatim u drugom koraku ispitujemo vrijednosti CO2 i HCO3- u plazmi.
● pCO2 je određen ventilacijom pluća, dakle to je respiratorna komponenta acidobazne ravnoteže.
● pCO2 > 40 mmHg – respiratorna acidoza
● PCO2 < 40 mmHg – respiratorna alkaloza
HCO3- je metabolička komponenta acidobazne ravnoteže, dakle, reguliše se aktivnošću bubrega.
● HCO3- < 24 mmol/L - metabolička acidoza
● HCO3- > 24 mmol/L - metabolička alkaloza
Ovdje primjećujemo da porast vrijednosti respiratorne komponente (CO2) dovodi do acidoze a porast vrijednosti metaboličke komponente (HCO3-) dovodi do alkaloze što je veoma važno zapamtiti za dalju interpretaciju nalaza.
Shodno svemu navedenom, ako se poremećaj karakteriše acidozom (nizak pH) a pCO2 plazme je povišen onda je to respiratorna komponenta acidoze. Metabolička komponenta (HCO3-) će onda nakon bubrežne kompenzacije težiti da se poveća kako bi se izbalansirao poremećaj. Prema tome, očekivane vrijednosti u prostoj respiratornoj acidozi bi bile snižen pH, povišen pCO2 i povišen HCO3-.
Kod proste respiratorne alkaloze je onda obratno, povišen pH, snižen pCO2 i nakon bubrežne kompenzacije snižena koncentracija HCO3- u plazmi.
Ako se poremećaj pH karakteriše acidozom (nizak pH) i niskom koncentracijom HCO3- onda je u pitanju poremećaj metaboličke komponente acidobazne ravnoteže. Kao posljedica kompenzacije pCO2 će biti snižen. Dakle kod proste metaboličke acidoze pH je snižen, HCO3- snižen i i nakon respiratorne kompenzacije PCO2 je snižen.
Kod proste metaboličke alkaloze je opet obratno, pH je povišen, povišena je koncentracija HCO3- i nakon respiratorne kompenzacije je povišen pCO2.
Postoje i složeni acidobazni poremećaji kada je izvor neravnoteže i metabolička i respiratorna komponenta ( npr. pacijent koji gubi HCO3- iz GIT-a zbog dijareje a koji ima i emfizem) ali o tome ćemo drugi put.
ANJONSKI ZJAP
Koncentracija anjona i katjona u plazmi mora biti jednaka da bi se održala elektrolitska neutralnost. Shodno tome “anjonski zjap” u plazmi u suštini ne postoji i on se koristi samo kao dijagnostički koncept. U kliničkoj praksi se određuju samo neki katjoni i anjoni i uglavnom se mjeri Na+ od katjona i Cl- i HCO3- od anjona.
Anjonski zjap je zapravo razlika između anjona i katjona koji se rutinski ne određuju i utvrđuje se kao:
ANJONSKI ZJAP PLAZME = Na+ - HCO3- - Cl- = 144 – 24 – 106 = 10 mmol/L
Anjonski zjap će se povećati ako se koncentracija anjona koji se ne određuju poveća ili ako se koncentracija katjona koji se ne određuju snizi. Najznačajniji katjoni koji se ne određuju su Ca, Mg i K a glavni anjoni koji se ne određuju su albumin, fosfat, sulfat i drugi organski anjoni. Anjoni koji se ne određuju obično nadmašuju katjone koji se ne određuju i opseg anjonskog zjapa je između 8 i 16 mmol/L. Anjonski zjap se koristi uglavnom u dijagnostici različitih uzoraka metaboličke acidoze. U metaboličkoj acidozi HCO3- plazme je snižen. Ako koncentracija Na+ nije promijenjena, koncentracija anjona (Cl- ili anjona koji se ne određuju) mora se povećati da se održi elektroneutralnost. Ako se Cl- plazme povećaju proporcionalno padu bikarbonatnih jona, anjonski zjap će ostati u opsegu normalnih vrijednosti i to se često označava kao hiperhloremijska metabolička acidoza. Ako smanjenje bikarbonatnih jona plazme nije praćeno povećanjem hloridnih jona moraju se povećati nivoi anjona koji se ne određuju i posljedično tome izračunati anjonski zjap. Metabolička acidoza uzrokovana viškom nevolatilnih kiselina kao što su mliječna ili ketokiseline udružena je sa povećanim anjonskim zjapom plazme zato što pad bikarbonatnih jona nije praćen porastom hloridnih jona. Izračunavanjem anjonskog zjapa moguće je suziti potencijalne uzroke metaboličke acidoze.
BAZNI EKSCES (BE)
BE je količina baze (mmol/l) koju treba dodati krvi da bi pH bio 7,40. Jednostavnije rečeno, BE predstavlja metaboličku komponentu acidobaznog poremećaja.
● Pozitivan BE – metabolička alkaloza
● Negativan BE – metabolička acidoza
Bio je to sažetak fiziologije acidobazne ravnoteže a u narednim člancima ćemo detaljnije govoriti o poremećajima acidobazne ravnoteže te dijagnostičkim procedurama i terapiji.
LITERATURA:
- http://www.msd-prirucnici.placebo.hr/msd-prirucnik/endokrinologija/acidobazna-ravnoteza-i-njeni-otkloni (24.04.2021. 22:00)
- https://acutecaretesting.org/en/articles/an-introduction-to-acidbase-balance-in-health-and-disease (22.04.2021. 13:30)
- https://courses.lumenlearning.com/boundless-ap/chapter/acid-base-balance/ (20.04.2021. 18:00)
- https://www.healthline.com/health/acid-base-balance (24.04.2021. 19:00)
- https://www.slideshare.net/drpathology/acid-base-disorders-stmu (22.04.2021. 21:00)
- https://www.vzsbeograd.edu.rs/attachments/article/397/Poremecaji%20acidobazne%20ravnoteze%202020.pdf (23.04.2021. 21:30)
- http://www.ikvbd.com/wp-content/uploads/2017/09/Gasne-analize-arterijske-i-venske-krvi.pdf (25.04.2021.23:48)
- Medicinska Fiziologija, Arthur C. Guyton, Md, John E. Hall, Ph. D. “Savremena Administracija”, Beograd, 2008. str. 383.- 400.